


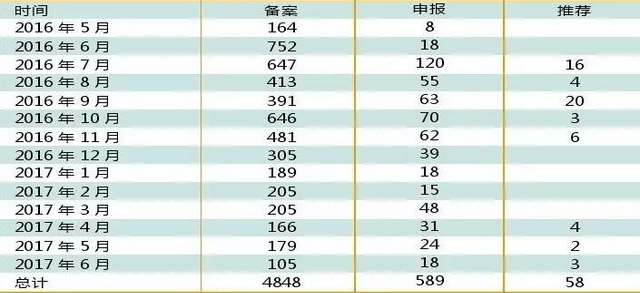
据中国食品药品检定研究院公布的截至2017年6月20日期间企业参比制剂备案情况,目前共有5495个企业产品品规被登记在案。
图1、截至2017年06月国内企业参比制剂备案情况
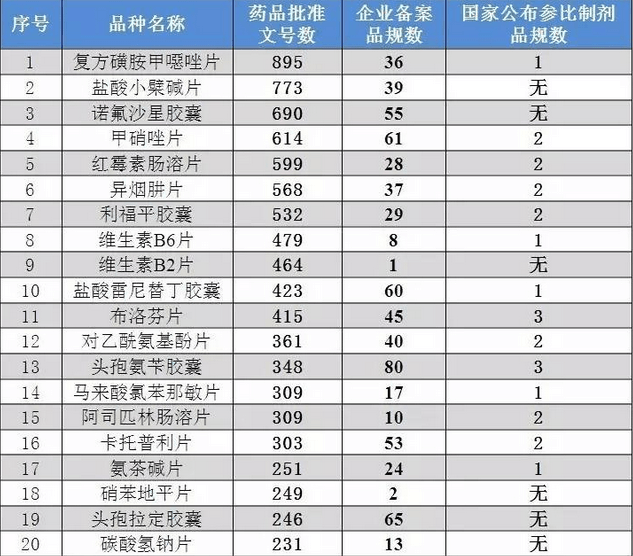
其中在289个仿制药质量和疗效一致性评价品种中,批准文号排名前20个产品共9059个批准文号,占289目标批准文号数的51%。而排名前20产品企业备案品规数仅703个,仅占9059个批准文号的8%。
图2、289品种批准文号排名前20产品备案情况
按照CFDA发布的《关于2018年底前须仿制药质量和疗效完成一致性评价品种批准文号信息》,我国 2018年底前须完成仿制药质量和疗效一致性评价品种的批准文号数量为17740个,对应了289个通用名。另据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)要求, 凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2018年底前完成一致性评价,且自第一家申请企业通过一致性评价后,三年后不再受理其他药品生产企业的同品种一致性评价申请。由此可推断,若药品生产企业的品种未能及时进行一致性评价,则该品种未来被淘汰的风险非常大。
来源:国家食品药品监督管理总局官网